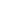医疗器械注册流程
1. 准备注册资料
在开始注册之前,企业需要对所需的注册资料进行充分准备,包括上述提到的所有技术文档、质量管理体系文件、检验报告等。准备工作需要细致而规范,确保每项资料都符合国家药监局的要求。
2. 提交注册申请
完成资料准备后,企业需向国家药监局提交注册申请。提交后,药监局将对企业提供的资料进行初步审查。如果审查过程中发现资料不完整或有问题,企业将被要求补充材料或进行修改。
3. 审查与批准
国家药监局会对提交的材料进行详细审查,包括对技术文件、临床试验报告、产品样本等进行逐项核查。审查过程中,药监局可能会要求企业提供更多信息或进行补充实验。如果所有材料合格,药监局将批准注册申请,企业将获得二类医疗器械注册证书。
4. 领取注册证书
在注册批准后,企业将领取正式的注册证书。此时,企业的二类医疗器械产品可以合法进入市场销售。企业需要注意,注册证书通常是有有效期的,期满后需要按规定进行续期。
关于 二类医疗器械注册流程 的文章是由【谷骐财税:http://www.guqicaishui.com/news/csjd/5437.html】整理或转载,谷骐财税提供公司注册、代理记账、税务代办、审计税筹等专业财税服务,为您解决代办各种财税疑难问题,欢迎您的咨询!
其他代理记账的相关内容
(顾问1分钟内响应)
预约服务>
在线客服>
上一篇:二类医疗器械注册要求
下一篇:吊销营业执照如何处理
热门回答